You are looking for information, articles, knowledge about the topic nail salons open on sunday near me synthese de l ammoniac corrigé on Google, you do not find the information you need! Here are the best content compiled and compiled by the toplist.prairiehousefreeman.com team, along with other related topics such as: synthese de l ammoniac corrigé synthèse industrielle de lammoniac, autour de l’ammoniac corrigé, synthèse ammoniac exercice, la synthèse de lammoniac se produit selon cette équation de réaction non ajustée, cours ammoniac, équilibre chimique exercices corrigés pdf, synthèse de l’ammoniac tableau d’avancement, procédé de fabrication d’ammoniac pdf
Comment se fabrique l’ammoniaque ?
L’ammoniac était produit par distillation du purin et du fumier, puis jusqu’au milieu du XIXe siècle il est extrait des eaux-vannes dans lesquelles il se forme par décomposition de l’urée. Après 1850, on l’obtient comme sous-produit de l’industrie du gaz de ville.
Quel est le bilan chimique de l’ammoniac ?
…
Ammoniaque.
| Identification | |
|---|---|
| Apparence | solution très volatile, incolore, d’ammoniac dans l’eau, d’odeur âcre. |
| Propriétés chimiques | |
| Formule | NH4OH |
| Masse molaire | 35,045 8 ± 0,000 9 g/mol H 14,38 %, N 39,97 %, O 45,65 %, |
Quelle est la composition de l’ammoniac ?
L’ammoniac est un composé chimique gazeux incolore, à base d’hydrogène et d’azote. Il est reconnaissable à sa forte odeur, suffocante et piquante. Sa formule moléculaire est « NH3 ».
Comment calculer le pKa de l’ammoniac ?
A l’équilibre, [NH4+]/([NH3][H3O+]) est un rapport de valeur constante et égale à Ka. Le pKa, égal à -log (Ka), vaut 9,2 (donnée propre au couple NH4+/NH3).
Qui fabrique l’ammoniac ?
L’ammoniac, produit à partir de gaz naturel, est de plus en plus fabriqué et exporté par les pays producteurs de cette matière première et, en particulier, par la Chine, par la Russie, l’Indonésie, les pays du Golfe….
Pourquoi la chaleur transforme l’urée en ammoniac ?
Agent de réduction des oxydes d’azote
En raison de la température élevée, l’urée se décompose en ammoniac et en dioxyde de carbone. L’ammoniac réagit à son tour avec les oxydes d’azote pour former, par une réaction de réduction, du diazote et de l’eau.
Quelle est la différence entre l’ammoniac et l’ammoniaque ?
Ne pas confondre ammoniac et ammoniaque
Lorsqu’on dissout du gaz ammoniac dans de l’eau, on obtient de l’hydroxyde d’ammonium, également appelé ammoniaque (se souvenir de la terminaison évoquant « aqueux »). La formule chimique de l’ammoniac est NH3, celle de l’ammoniaque est NH4OH.
Quel est le rôle de l’ammoniaque ?
La plus grande partie de l’Ammoniac utilisé sert à fabriquer des engrais chimiques, intégrant le cycle de l’azote. Il sert également comme gaz réfrigérant, comme composant de matières plastiques, d’explosifs, de tissus, de pesticides et même de colorants.
Pourquoi NH3 est une base ?
L’ammoniac NH3 capte un proton H+ de l’eau pour former NH4+. De même, il réagit avec l’eau pour former un ion OH– : L’ammoniac est donc à la fois une base de Brønsted et une base d’Arrhenius.
Où se trouve l’ammoniac ?
La présence d’ammoniac (naturel ou anthropique) dans les eaux de surface est liée aux apports terrigènes (dépôts secs et pluviaux, apports par les fleuves et estuaires), mais aussi liée à l’activité zooplanctonique et à la décomposition de phytoplancton ou de zooplancton ou d’autres organismes marins.
Qu’est-ce que l’ammoniac liquide ?
L’ammoniac est une molécule de formule chimique NH3 qui se présente sous la forme d’un gaz à température ambiante et à pression normale. Il peut également être stocké sous une forme liquide à basse température (sous -33°C) et/ou lorsqu’il est comprimé. Dans ce cas, on parle d’ammoniac liquide.
Est-ce que l’ammoniac est une matière organique ?
L’ammoniac (NH3) est un gaz qui se forme à partir de l’urine et de la fermentation de la matière organique. Ce composé fait partie intégrante du cycle de l’azote. Une fois dissout dans les gouttes d’eau des nuages, il donne de l’ammonium (NH4+).
Comment calculer le pH de NH3 ?
+/NH3) = 9.25. + est un acide faible ; il va rester de façon prédominante sous cette forme (pH 〈 pKa). La solution est une solution acide : on peut donc prévoir que le pH de cette solution est inférieur à 7. soit [H3O+] = [OH-]+[NH3] or [H3O+] >> [OH-] (la solution est acide) donc [H3O+] ≈ [NH3].
Comment calculer la concentration de l’ammoniac ?
Sa densité est de 0,885 . Le volume de solution est alors de 1000g : 0,885 = 1130 ml contenant 320g de NH3 . La concentration par litre = ( 320 : 1130 x 1000 ) = 283g de NH3 soit une solution 16,6 molaire .
Pourquoi NH3 NH4Cl est une solution tampon ?
La solution tampon contient NH3 et NH4Cl et NH4Cl est dissocié totalement en NH4+ et Cl- . L’ion Cl- est un ion spectateur donc on ne va pas s’en occuper . Donc on peut dire que la solution de départ contient NH4+ et NH3 .
synthese de l ammoniac corrigé
- Article author: dlecorgnechimie.fr
- Reviews from users: 44790
Ratings
- Top rated: 4.9
- Lowest rated: 1
- Summary of article content: Articles about synthese de l ammoniac corrigé Equilibres chimiques & cinétique macroscopique. CORRIGE … La synthèse de l’ammoniac NH3, au même titre que la synthèse de l’ace sulfurique, est. …
- Most searched keywords: Whether you are looking for synthese de l ammoniac corrigé Equilibres chimiques & cinétique macroscopique. CORRIGE … La synthèse de l’ammoniac NH3, au même titre que la synthèse de l’ace sulfurique, est.
- Table of Contents:

synthese de l ammoniac corrigé
- Article author: www.lycee-champollion.fr
- Reviews from users: 26607
Ratings
- Top rated: 3.0
- Lowest rated: 1
- Summary of article content: Articles about synthese de l ammoniac corrigé La synthèse de l’ammoniac est réalisée par réaction directe entre le dihydrogène et le diazote, en présence d’oxydes de fer comme catalyseur selon :. …
- Most searched keywords: Whether you are looking for synthese de l ammoniac corrigé La synthèse de l’ammoniac est réalisée par réaction directe entre le dihydrogène et le diazote, en présence d’oxydes de fer comme catalyseur selon :.
- Table of Contents:

synthese de l ammoniac corrigé
- Article author: rtc.ma
- Reviews from users: 48667
Ratings
- Top rated: 4.4
- Lowest rated: 1
- Summary of article content: Articles about synthese de l ammoniac corrigé Principe de Le Châtelier pour la pression : à température constante, une augmentation de la pression permet de déplacer l’équilibre dans le sens qui diminue … …
- Most searched keywords: Whether you are looking for synthese de l ammoniac corrigé Principe de Le Châtelier pour la pression : à température constante, une augmentation de la pression permet de déplacer l’équilibre dans le sens qui diminue …
- Table of Contents:

synthese de l ammoniac corrigé
- Article author: cahier-de-prepa.fr
- Reviews from users: 43653
Ratings
- Top rated: 4.3
- Lowest rated: 1
- Summary of article content: Articles about synthese de l ammoniac corrigé 1 Synthèse industrielle de l’ammoniac. 1. Bloc 1 : reformage. (a) D’après le schéma de principe, le diazote N2 est issu de l’air et le dihydrogène provient … …
- Most searched keywords: Whether you are looking for synthese de l ammoniac corrigé 1 Synthèse industrielle de l’ammoniac. 1. Bloc 1 : reformage. (a) D’après le schéma de principe, le diazote N2 est issu de l’air et le dihydrogène provient …
- Table of Contents:

Ammoniac – Produits SCF – Société Chimique de France (SCF)
- Article author: new.societechimiquedefrance.fr
- Reviews from users: 47409
Ratings
- Top rated: 3.3
- Lowest rated: 1
- Summary of article content: Articles about Ammoniac – Produits SCF – Société Chimique de France (SCF) Updating …
- Most searched keywords: Whether you are looking for Ammoniac – Produits SCF – Société Chimique de France (SCF) Updating L’ammoniac est connu depuis que les alchimistes arabes en traitant par la chaux le « sel ammoniac » (en fait le chlorure d’ammonium, obtenu dès
- Table of Contents:

Ammoniaque — Wikipédia
- Article author: fr.wikipedia.org
- Reviews from users: 5190
Ratings
- Top rated: 3.8
- Lowest rated: 1
- Summary of article content: Articles about Ammoniaque — Wikipédia Updating …
- Most searched keywords: Whether you are looking for Ammoniaque — Wikipédia Updating
- Table of Contents:
Description[modifier modifier le code]
Dangerosité[modifier modifier le code]
Utilisation[modifier modifier le code]
Réactivité[modifier modifier le code]
Notes et références[modifier modifier le code]
Voir aussi[modifier modifier le code]

L’ammoniac, un puissant dérivé de l’azote – Geo.fr
- Article author: www.geo.fr
- Reviews from users: 12390
Ratings
- Top rated: 3.7
- Lowest rated: 1
- Summary of article content: Articles about
L’ammoniac, un puissant dérivé de l’azote – Geo.fr Updating … - Most searched keywords: Whether you are looking for
L’ammoniac, un puissant dérivé de l’azote – Geo.fr Updating L’ammoniac est un gaz présent à l’état naturel qui dégage une odeur âcre et irritante. Ses applications sont nombreuses : il sert à la conception… - Table of Contents:
Les propriétés de l’ammoniac
Utilisation de l’ammoniac
Les dangers du NH3
THÈMES ASSOCIÉS À L’ARTICLE
À DÉCOUVRIR
SUR LE MÊME THÈME

Ammoniaque NH4OH – Astuces Pratiques
- Article author: www.astuces-pratiques.fr
- Reviews from users: 44246
Ratings
- Top rated: 3.5
- Lowest rated: 1
- Summary of article content: Articles about Ammoniaque NH4OH – Astuces Pratiques Updating …
- Most searched keywords: Whether you are looking for Ammoniaque NH4OH – Astuces Pratiques Updating NH4OH ou NH3 ? La formule de l’ammoniac ou ammoniaque prête parfois à confusion. Pour comprendre pourquoi les deux formules chimiques sont justes, il faut
- Table of Contents:
Plan de l’article
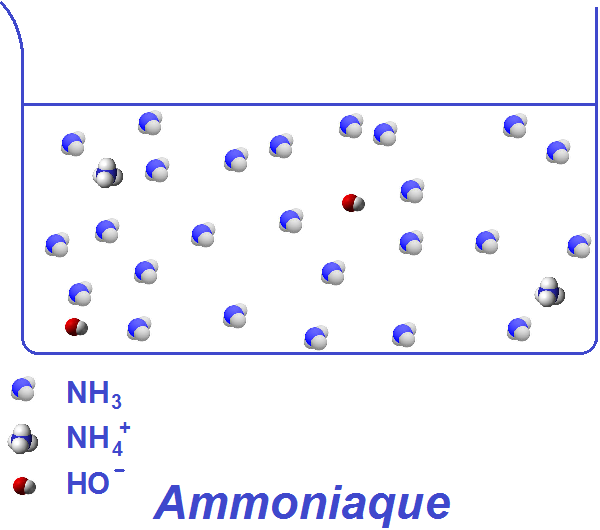
Ammoniac (NH3 gaz) et ammoniaque (eau NH3 dissous NH4+ HO-)
Exercice corrigé calcul de pH d’une solution d’ammoniaque
Pourcentage de dissociation de l’ammoniac
Formules générales pour calculer des pH d’acides et bases faibles ou forts
NH4OH hydroxyde d’ammonium mais encore
L’ammoniac un base pour les engrais de jardin
synthese de l ammoniac corrigé
- Article author: www.cpgemaroc.com
- Reviews from users: 46028
Ratings
- Top rated: 4.9
- Lowest rated: 1
- Summary of article content: Articles about synthese de l ammoniac corrigé L’ammoniac est une substance naturelle qui peut également être produite en grandes quantités par synthèse chimique. Il est l’un des plus importants produits. …
- Most searched keywords: Whether you are looking for synthese de l ammoniac corrigé L’ammoniac est une substance naturelle qui peut également être produite en grandes quantités par synthèse chimique. Il est l’un des plus importants produits.
- Table of Contents:

Synthèse de l’Ammoniac : exercice de sciences physiques de maths sup – 287013
- Article author: www.ilephysique.net
- Reviews from users: 12913
Ratings
- Top rated: 4.9
- Lowest rated: 1
- Summary of article content: Articles about Synthèse de l’Ammoniac : exercice de sciences physiques de maths sup – 287013 Synthèse de l’Ammoniac : exercice de sciences physiques de niveau maths sup – Forum de physique – chimie. …
- Most searched keywords: Whether you are looking for Synthèse de l’Ammoniac : exercice de sciences physiques de maths sup – 287013 Synthèse de l’Ammoniac : exercice de sciences physiques de niveau maths sup – Forum de physique – chimie. Synthèse de l’Ammoniac : exercice de sciences physiques de niveau maths sup – Forum de physique – chimieSynthèse,de,l’Ammoniac
- Table of Contents:

synthese de l ammoniac corrigé
- Article author: timogiant.free.fr
- Reviews from users: 7581
Ratings
- Top rated: 3.4
- Lowest rated: 1
- Summary of article content: Articles about synthese de l ammoniac corrigé Les différents constituants dont il sera question dans ce problème sont des gaz parfaits. • L’enthalpie standard de formation de l’ammoniac : (. ) °. …
- Most searched keywords: Whether you are looking for synthese de l ammoniac corrigé Les différents constituants dont il sera question dans ce problème sont des gaz parfaits. • L’enthalpie standard de formation de l’ammoniac : (. ) °.
- Table of Contents:

synthese de l ammoniac corrigé
- Article author: gmet.edupage.org
- Reviews from users: 42017
Ratings
- Top rated: 3.0
- Lowest rated: 1
- Summary of article content: Articles about synthese de l ammoniac corrigé L’ammoniac est synthétisé à partir d’un mélange de dihydrogène et de diazote en … La réaction de synthèse de l’ammoniac est-elle une réaction totale ? …
- Most searched keywords: Whether you are looking for synthese de l ammoniac corrigé L’ammoniac est synthétisé à partir d’un mélange de dihydrogène et de diazote en … La réaction de synthèse de l’ammoniac est-elle une réaction totale ?
- Table of Contents:

synthese de l ammoniac corrigé
- Article author: www.mmelzani.fr
- Reviews from users: 40082
Ratings
- Top rated: 4.2
- Lowest rated: 1
- Summary of article content: Articles about synthese de l ammoniac corrigé I Procédé Haber-Bosh de synthèse de l’ammoniac avec catalyseur à base de fer. Extrait de CCP TSI chimie 2013. I.1 Le fer, base du catalyseur du procédé … …
- Most searched keywords: Whether you are looking for synthese de l ammoniac corrigé I Procédé Haber-Bosh de synthèse de l’ammoniac avec catalyseur à base de fer. Extrait de CCP TSI chimie 2013. I.1 Le fer, base du catalyseur du procédé …
- Table of Contents:

Exercice VIII-14 : Etude thermochimique de la synthèse de l’ammoniac – MOAM.INFO
- Article author: mafiadoc.com
- Reviews from users: 28187
Ratings
- Top rated: 3.0
- Lowest rated: 1
- Summary of article content: Articles about Exercice VIII-14 : Etude thermochimique de la synthèse de l’ammoniac – MOAM.INFO Exercice. Exercice VIII-14 : Etude thermochimique de la synthèse de l’ammoniac. Industriellement, la synthèse de l’ammoniac se fait selon l’équilibre :. …
- Most searched keywords: Whether you are looking for Exercice VIII-14 : Etude thermochimique de la synthèse de l’ammoniac – MOAM.INFO Exercice. Exercice VIII-14 : Etude thermochimique de la synthèse de l’ammoniac. Industriellement, la synthèse de l’ammoniac se fait selon l’équilibre :. Page 1. Claude ANIES. EduKlub S.A.. Tous droits de l’auteur des œuvres réservés. Sauf autorisation, la reproduction a…
- Table of Contents:
Exercice VIII-14 Etude thermochimique de la synthèse de l’ammoniac
Suggest Documents

See more articles in the same category here: https://toplist.prairiehousefreeman.com/blog.
Société Chimique de France (SCF)
L’ammoniac est connu depuis que les alchimistes arabes en traitant par la chaux le « sel ammoniac » (en fait le chlorure d’ammonium, obtenu dès l’Antiquité par la pyrolyse des excréments de chameau…) constatèrent la formation d’un gaz suffocant. Ce fut Joseph Priestley qui, en 1774, l’isola en le recueillant sur cuve à mercure et lui donna le nom « d’air alcalin », mais c’est Claude Louis Berthollet, qui, en 1785, en fit l’analyse et indiqua sa composition centésimale correspondant à la formule NH 3 .
L’ammoniac est une molécule présentant une structure pyramidale à base trigonale : l’atome d’azote (N) est au sommet et les trois atomes d’hydrogène (H) occupent les trois sommets de la base triangulaire équilatérale. En fait, l’atome d’azote « monte » et « descend » entre ce « sommet » de la pyramide et celui de la pyramide opposée, traversant ainsi la base triangulaire des atomes d’hydrogène. Cette oscillation s’effectue 24 milliards de fois par seconde (24 GHz) et a été exploitée dans les premières horloges atomiques.
L’ammoniac est très soluble dans l’eau. Ces solutions, communément appelées ammoniaque, sont faiblement basiques et de ce fait considérées comme des solutions d’hydroxyde d’ammonium (NH 4 OH). Toutefois, la dissociation en ions [NH 4 ]+ (ammonium ) et [OH]– (hydroxyde) est très faible, expliquant ce comportement. En réalité, ces solutions sont surtout constituées des hydrates NH 3 •OH 2 , 2NH 3 •OH 2 et NH 3 •2OH 2 associant des molécules d’ammoniac et d’eau par des liaisons hydrogène N…H—O. L’ammoniac peut également perdre un proton, H+, et donner l’ion amidure, NH 2 –, qui est une base forte.
L’ammoniac était produit par distillation du purin et du fumier, puis jusqu’au milieu du XIXe siècle il est extrait des eaux-vannes dans lesquelles il se forme par décomposition de l’urée. Après 1850, on l’obtient comme sous-produit de l’industrie du gaz de ville. La carbonisation de la houille donne en effet lieu à la formation d’ammoniac, qui se condense sous forme d’eaux ammoniacales, puis est fixé à l’état de sulfate d’ammonium, utilisé comme engrais. A la même époque, l’importance de l’ammoniac comme constituant des engrais azotés va poser la question de voies de production industrielle des engrais qui allait révolutionner la préparation de l’ammoniac, mais aussi l’industrie chimique par le recours à la catalyse et aux réactions sous pression. Le problème de la fixation du diazote de l’air était posé.
Bien que 78,1 % de l’air que nous respirons soit constitué de diazote, celui-ci est relativement peu réactif du fait de la présence d’une triple liaison entre les deux atomes . Dès le début du 20e siècle de nombreux chimistes ont essayé de produire l’ammoniac par réaction du dihydrogène avec le diazote.
N 2 + 3 H 2 ———> 2 NH 3
C’est en 1909 que cette hydrogénation, effectuée en présence d’un catalyseur à base d’oxydes de fer, a été démontrée grâce à l’emploi d’équipements à haute pression fonctionnant en continu mis au point par Robert Le Rossignol.
Le procédé a été acheté par la BASF (Badsiche und Anilin Soda Fabrik) qui a confié à Karl Bosch la tâche difficile de développer à l’échelle industrielle le procédé qui porte le nom de procédé Haber-Bosch. La première usine de production catalytique d’ammoniac a démarré en 1913 à Oppau, seulement 4 ans après la démonstration de sa faisabilité en laboratoire. L’un des premiers «tubes de synthèse,» long de dix mètres, constitué de deux éléments pesant une vingtaine de tonnes est exposé à l’Université de Karlsruhe à proximité du laboratoire de la découverte du procédé (cf. la vignette d’annonce). Ces travaux séminaux en catalyse et technologie haute pression en continu ont été récompensés par le prix Nobel de Chimie, en 1918 pour F. Haber ({à droite) et en 1931 pour K. Bosch ({à gauche).
Le procédé de Haber-Bosch fournit actuellement 150 Mt/an d’ammoniac, employés principalement pour la fabrication de 100 Mt/an d’engrais azotés, sous forme d’ammoniac, de nitrate d’ammonium, et d’urée. Cette production consomme 3-5 % de la production mondiale de gaz naturel, source du dihydrogène nécessaire pour sa préparation. On estime que l’ammoniac est directement responsable du tiers de l’accroissement de la population mondiale depuis le milieu du XXe siècle grâce aux progrès de l’agriculture et à la disparition des grandes famines.
Avec l’ammoniac, la chimie offre à l’homme l’une de ces possibilités étonnantes dont il peut se servir pour le bien ou le mal : constituant et matière première de la plupart des engrais azotés, il sert également à fabriquer l’acide nitrique, lui-même utilisé dans la fabrication de la plupart des explosifs. Il est également envisagé comme carburant pour moteurs à combustion interne, employé comme fluide de réfrigération sans effet de serre, solvant et intermédiaire dans la synthèse de très nombreux produits azotés.
La pensée du jour
« Ammoniac : vraiment démoniaque ? »
Sources
– http://fr.wikipedia.org/wiki/Ammoniac
– http://encyclopedia.airliquide.com/encyclopedia.asp?GasID=2&CountryID=19&LanguageID=2
– www.societechimiquedefrance.fr/extras/Donnees/mine/nh3/texnh3.htm
– www.inrs.fr/htm/ammoniac_et_solutions_aqueuses.html
– http://en.wikipedia.org/wiki/Ammonia
– http://fr.wikipedia.org/wiki/Procédé_Haber
– http://en.wikipedia.org/wiki/Haber_process
– http://fr.wikipedia.org/wiki/Fixation_biologique_de_l%27azote
– http://fr.wikipedia.org/wiki/Cycle_de_l’azote
Pour en savoir plus
– Azote
– Hydrogène
Ammoniaque — Wikipédia
L’ammoniaque est la solution aqueuse basique de l’ammoniac, c’est-à-dire le produit de la dissolution de l’ammoniac NH 3 à l’état gazeux dans l’eau. Elle peut être notée NH 3 ·H 2 O , NH 4 OH ou, mieux, NH 3 (aq) .
L’ammoniaque est un produit industriel, mais peut également être aussi une solution commercialisée contenant 35 % d’ammoniac en masse. NH 3 (aq) est un alcali (une base) commun en teinturerie, qui entre dans la fabrication de fibres textiles et de leurs apprêts, des papiers et de leurs couchages, et est aussi employé par l’industrie chimique et pharmaceutique[9].
L’eau réagissant avec l’ammoniac, base faible, pour produire des cations ammonium NH 4 + et des anions hydroxyde HO− en quantités égales, cette solution a aussi été appelée « solution d’hydroxyde d’ammonium », et la formule statistique (NH 4 + (aq) + HO− (aq) ) lui a été attribuée. Pour autant, le composé NH 4 OH (hydroxyde d’ammonium) n’a jamais été isolé, et seule une faible proportion (environ 1 %) des molécules NH 3 est effectivement hydrolysée en NH 4 + et HO−.
L’ammoniaque laisse émaner une odeur d’ammoniac, gaz qui la compose principalement et s’en échappe assez spontanément ; la solution aqueuse libère à chaud encore plus facilement le gaz ammoniac, irritant, à forte odeur piquante et souvent désagréable. L’odeur caractéristique ammoniaquée se retrouve à proximité des urinoirs ou sur les habits sales ou imprégnés par une forte sudation, lentement séchés puis mouillés subitement.
Le gaz ammoniac est facilement soluble dans l’eau. Un litre d’eau peut piéger 1 148 L de gaz à 0 °C . Mais la pression de vapeur est élevée, et il est facile d’extirper le gaz en chauffant la solution ammoniaque concentrée.
La pression de vapeur d’ammoniac dans une solution concentrée à 60 % en masse est de l’ordre de 380 mmHg à 0 °C , 600 mmHg à 10 °C , 945 mmHg à 20 °C , 2 130 mmHg à 40 °C .
L’ammoniac en solution réagit de manière équilibrée avec l’eau selon l’équation suivante :
Le pK a (constante d’acidité) du couple NH+
4 /NH 3 étant de 9,23, cette réaction est limitée à environ 1 %. La libération d’ions hydroxyde (HO−) confère cependant à l’ammoniaque son caractère basique, avec un pH approximatif de 11,6 pour une solution molaire.
Bouteille d’ammoniaque en vente en Russie.
Les solutions commerciales d’ammoniaque sont concentrées et très dangereuses. D’après l’Institut national de recherche et de sécurité (INRS), la solution commerciale provoque des brûlures et doit être manipulée avec des vêtements appropriés (gants, protection du visage et des yeux)[10]. L’aération du local va de soi, y compris pour les travaux ménagers. L’origine de l’irritation provoquée par un contact de l’ammoniaque avec la peau est le caractère réactif de la molécule d’ammoniac NH 3 vis-à-vis des membranes cellulaires. Cette réactivité vis-à-vis des milieux biologiques en fait un produit ménager efficace pour nettoyer, dégraisser, assainir.
En solution diluée, l’ammoniaque était employée par les médecins de la Belle Époque en inhalation, supposée roborative.
Le hákarl est un plat islandais qui contient de l’ammoniaque. Il est préparé à partir de la chair du requin du Groenland après en avoir longuement extrait une partie de l’urée.
L’ammoniac est régulièrement utilisé par l’industrie du tabac comme additif mélangé au tabac[11].
Les exemples de réactivité de l’ammoniaque sont nombreux. Cette solution possède les propriétés de l’ammoniac qui est à la fois une base, un ligand et un réducteur.
L’ammoniaque réagit avec le dioxyde de carbone (CO 2 ), qui peut se dissoudre dans l’eau en s’associant à une molécule d’eau, ce qui produit de l’acide carbonique H 2 CO 3 . Il s’agit d’une réaction acido-basique qui conduit au carbonate d’ammonium (NH 4 ) 2 CO 3 . Dans cette réaction, l’ammoniaque se comporte comme une base.
D’une manière générale, l’ammoniaque réagit avec les acides pour produire des sels d’ammonium quaternaires. Un grand nombre de ces sels sont des explosifs et des engrais.
L’ammoniaque ajoutée à une solution de sulfate de cuivre de couleur bleu clair donne un complexe ammine de métal de couleur bleu céleste très intense de formule [Cu(NH 3 ) 4 (H 2 O) 2 ] 2+. Dans cette réaction, l’ammoniaque apporte le ligand ammine NH 3 .
Une réaction antique, mystérieuse, était l’union de l’ammoniaque avec le « vif-argent », ou mercure métallique liquide. C’est pourquoi l’ammoniaque, ou encore le salmiac et d’autres sels d’ammonium quaternaires, était recherché par les forgerons et les métallurgistes : il favorisait le nettoyage des métaux et les soudures métalliques.
Le mélange d’ammoniaque concentrée avec le diiode conduit au triiodure d’azote NI 3 , qui est explosif à sec. Dans cette réaction, l’ammoniaque apporte le réducteur NH 3 et le diiode est l’oxydant.
Notes et références [ modifier | modifier le code ]
L’ammoniac, un puissant dérivé de l’azote
L’ammoniac est un composé chimique gazeux incolore, à base d’hydrogène et d’azote. Il est reconnaissable à sa forte odeur, suffocante et piquante. Sa formule moléculaire est « NH3 ». Il ne faut pas le confondre avec l’ammoniaque, dont la formule est « NH4OH », et qui renvoie à la forme liquide du premier, après sa dissolution dans l’eau. On parle de solution aqueuse basique de l’ammoniac. Il s’agit d’un puissant produit détachant et désinfectant.
Les propriétés de l’ammoniac
L’ammoniac existe naturellement dans le corps humain, où il joue le rôle de synthétiseur des acides aminés ainsi que des nucléotides. Dans l’environnement, le NH3 est formé à partir de la décomposition de matières organiques ou de bactéries présentes dans le sol.
L’ammoniac est hygroscopique, c’est-à-dire qu’il absorbe l’humidité. Il a une odeur âcre et son gaz est irritant. Très corrosif, il s’attaque aux métaux. Au contact de la peau, il peut provoquer des irritations et des brûlures.
Utilisation de l’ammoniac
L’industrie est le principal secteur d’application du NH3. 80 % de l’ammoniac produit sert à la fabrication d’engrais azoté pour l’agriculture. Directement injecté dans le sol, l’azote favorise grandement la croissance des plantes.
L’ammoniac est utilisé comme gaz réfrigérant dans l’industrie. Il peut intervenir dans la fabrication de plastiques, tissus ou pesticides. Le NH3 est aussi le produit de base dans la synthèse de l’acide nitrique utilisé dans la fabrication d’explosifs, comme le TNT.
Entre des mains farceuses, l’ammoniac peut même se transformer en boule puante…
Les dangers du NH3
L’ammoniac sous toutes ses formes est toxique. Mortel à haute dose, ce produit peut causer, par ingestion ou au contact, des brûlures, des douleurs abdominales et des évanouissements. Ainsi il est conseillé de diluer le produit dans une grande quantité d’eau avant une utilisation domestique.
L’ammoniac est aussi responsable de l’eutrophisation, une forme naturelle de pollution, créée par l’accumulation de nutriments. De plus, lorsqu’il est rejeté dans l’atmosphère, l’ammoniac est à l’origine d’une grande partie de l’acidification de l’eau et du sol. En 2010, la France était, avec 649 kilotonnes, le premier émetteur d’ammoniac de l’Union européenne. Le protocole de Göteborg, adopté par l’UE en 1999, a mis en place des seuils de tolérance pour réduire d’ici 2020 les impacts de la pollution atmosphérique sur la santé et l’environnement.
So you have finished reading the synthese de l ammoniac corrigé topic article, if you find this article useful, please share it. Thank you very much. See more: synthèse industrielle de lammoniac, autour de l’ammoniac corrigé, synthèse ammoniac exercice, la synthèse de lammoniac se produit selon cette équation de réaction non ajustée, cours ammoniac, équilibre chimique exercices corrigés pdf, synthèse de l’ammoniac tableau d’avancement, procédé de fabrication d’ammoniac pdf
